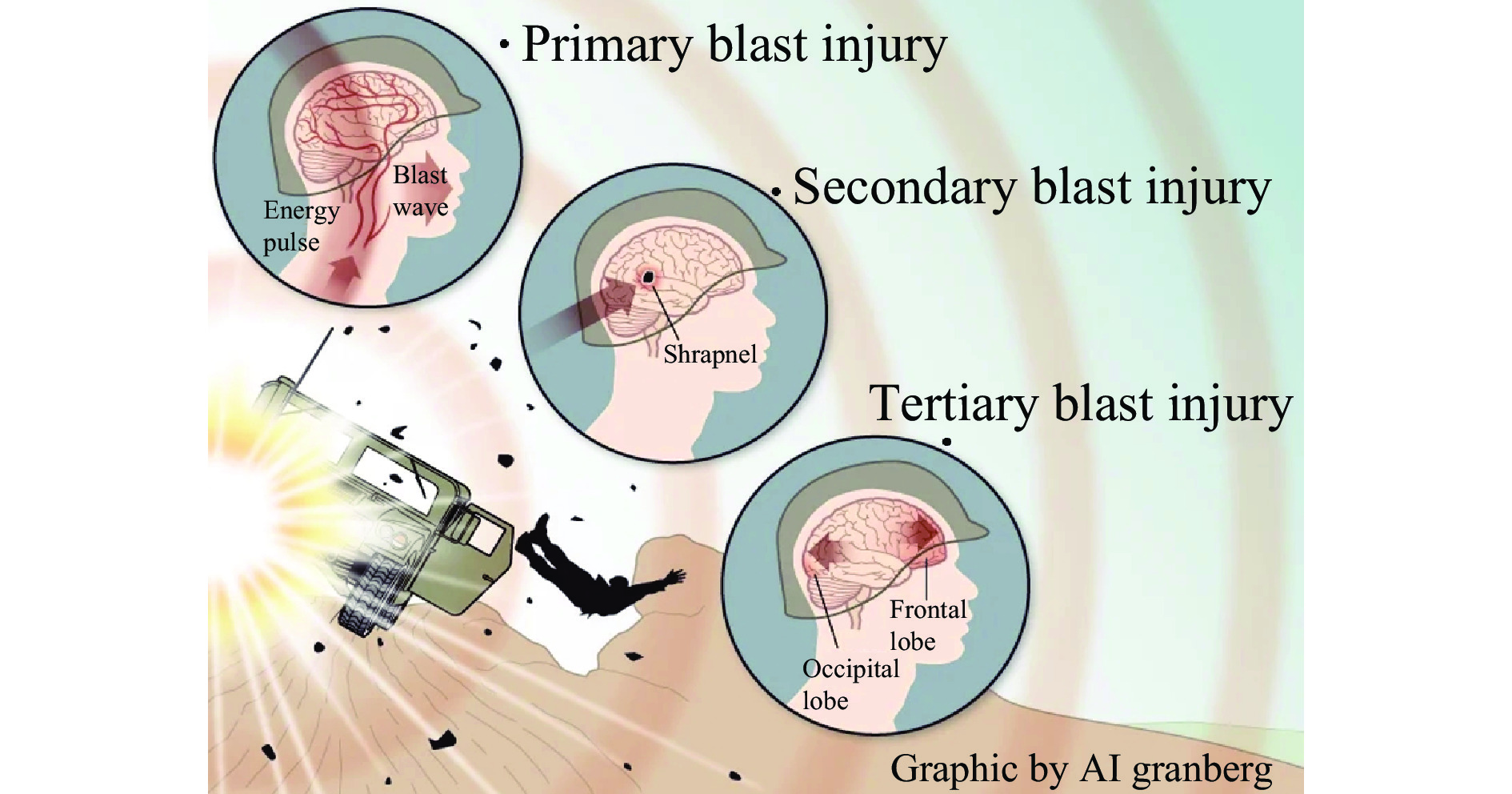
Progress in the mechanism and protection of blast-induced traumatic brain injury
-
摘要: 颅脑爆炸伤是现代战争中士兵面临的主要伤害之一,近年来受到广泛关注。冲击波经由颅脑传播带来的直接伤害被称为初级爆炸伤。目前,初级颅脑爆炸伤致伤机制尚不明确,可能是应力波传播、颅骨弯曲变形、颅脑空化及躯干压缩等多种因素共同作用的结果。该研究是涉及多学科交叉、多物理场耦合及短时和长时效应共存的复杂问题,需要通过建立描述冲击波和颅脑相互作用的高精度、多尺度和多物理场数值模型,发展测量颅骨应变、颅内压力、加速度等力学指标的物理测试系统,结合人体和动物病理、生理、行为学等综合因素分析,最终揭示颅脑爆炸伤致伤机制。本文中介绍了初级颅脑爆炸伤致伤机制,给出了颅脑爆炸伤的行为学、生理学相关的医学评价指标,以及颅骨应变、颅内压力等关键力学评估指标,提出了基于致伤机制和评价指标的防护结构设计方法,包括基于新型防冲击波材料的头盔系统改进、头盔缓冲系统设计、增加头部保护系统的封闭性等,最后展望了在精细化建模、原位实验及防护系统设计等诸多方面的发展趋势。Abstract: Blast-induced traumatic brain injury (bTBI) is one of the major injuries sustained by soldiers in armed conflict, which has been widely concerned by domestic and overseas researchers in recent years. The brain injury caused by a direct interaction between the blast wave and the head is called primary bTBI. Currently, the injury mechanism of primary bTBI is still unclear. The primary bTBI may be the combined result of multi-factors, such as stress wave propagation, skull flexural deformation, cerebrospinal fluid cavitation, and trunk compression. Since it is a complex problem involving the interdisciplinary of medical and engineering, multi-physical field coupling, and coexistence of short-term and long-term effects, it is necessary to reveal the injury mechanism of bTBI by combining physical experiments, numerical simulations, and medical diagnosis. There are three strategies to investigate bTBI. One is to establish a high-precision and multi-physical-field numerical model to describe the interaction of the blast wave and the head. The second is to develop a surrogate head model to measure the skull strain, intracranial pressure, acceleration, and other mechanical quantities. The third is to analyze human and animal pathology and physiology. Comparing the results of these three strategies can reveal the injury mechanism of bTBI in medicine and mechanics. The research status and development in this field are introduced in this paper based on the authors’ previous research. The evaluation indexes of bTBI are summarized, including the medical indexes related to behavior and physiology and the critical mechanical indexes, such as skull strain, intracranial pressure, and local stress. Furthermore, the protective structure design based on the injury mechanism and the evaluation indexes is described, including the improvement of the helmet system based on new materials, the design of the helmet buffer system, the increase of the sealing of the head protection system, etc. To figure out the bTBI mechanism, more accurate measurement of the in-situ mechanical properties of the brain tissue, and high fidelity numerical and physical models are needed. For bTBI protection research, it needs to improve the biological matching degree and the accuracy of the experimental platform. Finally, three development trends of the bTBI research are pointed out, including the development of multi-scale head models, accurate measurement and verification of the injury indexes and threshold, comprehensive investigation of injury mechanism, evaluation, and protection.
-
表 1 格拉斯哥昏迷评分
Table 1. Glasgow coma scale (GCS)
评分 眼睛状况 口头表达 动态行为 无法监测 例如:严重的眼外伤 例如:插管 例如:瘫痪 1 不睁眼 不能言语 刺痛下肢体不动 2 刺痛睁眼 只能发音 刺痛下有肢体伸直 3 呼唤睁眼 回答含糊不清 刺痛下有肢体屈曲 4 自动睁眼 回答有错误 刺痛下有躲避反应 5 − 回答正确 能定位刺痛位置 6 − − 按吩咐动作 致伤阈值计算受伤区域与行为学损伤区域匹配相关度 标准 压力/Pa Mises应力/Pa 等效应变 体积能量率/(J·s−1) 剪切能量率/(J·s−1) 轴突拉伸 轴突拉伸能量率/(J·s−1) 灰质 56 39 56 56 72 − − 白质 44 33 44 22 44 33 56 事件 机制 血清生物标志物 轻度创伤性脑损伤 中度创伤性脑损伤 严重创伤性脑损伤 神经元和神经胶质细胞死亡 激活触发坏死和/
或凋亡的因子神经元:NSE,Ctau,SBP,
所有血影蛋白神经元:NSE, PNF-H, NF-H,
NMDAR, Hsp70, UCH-L1, C-tau,
所有血影蛋白, SBP,促泌素神经元:NSE, PNF-H, NF-H,NMDAR, Hsp70, UCH-L1, C-tau,
所有血影蛋白, SBP, 促泌素神经胶质:S100β,
GFAP,MBP,C-tau神经胶质: S100β, GFAP,MBP,
NMDAR, Hsp70, IL-1β, L-6, L-8,
TN-α,C-tau, AQP4神经胶质: S100β, GFAP, MBP, NMDAR, Hsp70, IL-1β, IL-6,
IL-8, TN-α, C-tau, AQP4血管
痉挛血管收缩和松弛的失调 − Hsp70, TNF-α, VEGF,
Claudin-5, vWFHsp70, TNF-α, VEGF,
Claudin-5, vWF水肿 毒性和炎症因子引起的血管生成和细胞毒性事件 − Hsp70, IL-1β, IL-6, IL-8, VEGF, Claudin-5, vWF, AQP4, MMP9 Hsp70, IL-1β, IL-6, IL-8, VEGF, Claudin-5, vWF, AQP4, MMP9 轴突
损伤机械损伤;神经元变性 S100β, NSE, C-tau, MBP,
SBP, 所有血影蛋白S100β, MBP, NSE, PNF-H, NMDAR, Hsp70, C-tau,
所有血影蛋白, SBPS100β, MBP, NSE, PNF-H, NMDAR, Hsp70, C-tau,
所有血影蛋白, SBP炎症 细胞因子释放与细胞应激 IL-1β, IL-6, IL-8,
TNF-α, IFN -γHsp70, IL-1β, IL-6,
IL-8, TNF-α, IFN -γHsp70, IL-1β, IL-6, IL-8,
TNF-α, IFN -γ代谢
变化缺氧;能量需求改变、
离子稳态与神经传递;
增加了修复过程− 血浆铜蓝蛋白,HIF-1α 血浆铜蓝蛋白,HIF-1α -
[1] MAAS A I R, MENON D K, ADELSON P D, et al. Traumatic brain injury: integrated approaches to improve prevention, clinical care, and research [J]. The Lancet Neurology, 2017, 16(12): 987–1048. DOI: 10.1016/S1474-4422(17)30371-X. [2] PHIPPS H, MONDELLO S, WILSON A, et al. Characteristics and impact of U. S. military blast-related mild traumatic brain injury: a systematic review [J]. Frontiers in Neurology, 2020, 11: 559318. DOI: 10.3389/fneur.2020.559318. [3] TANIELIAN T, HAYCOX L H, SCHELL T L, et al. Invisible wounds of war. summary and recommendations for addressing psychological and cognitive injuries: ADA480992 [R/OL]. Santa Monica: Rand Corp, 2008. [2021-02-03]. https://apps.dtic.mil/sti/citations/ADA480992. [4] 马奔, 李文静. 天津港“8·12”事故应急合作网络与协同应对 [J]. 国家行政学院学报, 2017(4): 91–96. DOI: 10.3969/j.issn.1008-9314.2017.04.015. [5] 康清清, 顾勤平, 周昱辰, 等. 江苏响水“3·21”特大爆炸事故的地震学鉴别和当量估计 [C] // 2019年中国地球科学联合学术年会论文集(二十). 北京: 中国和平音像电子出版社, 2019. [6] 谢忠设. 危化品车辆运输, 该怎么疏通最后一公里? [J]. 中国石油和化工, 2020(9): 60–63. DOI: 10.3969/j.issn.1008-1852.2020.09.018. [7] 徐唯, 宋瑛, 梁爱民, 等. 特大爆炸事故幸存者创伤后应激障碍的初步研究 [J]. 中国心理卫生杂志, 2003, 17(9): 603–606. DOI: 10.3321/j.issn:1000-6729.2003.09.008. [8] MOORE D F, RADOVITZKY R A, SHUPENKO L, et al. Blast physics and central nervous system injury [J]. Future Neurology, 2008, 3(3): 243–250. DOI: 10.2217/14796708.3.3.243. [9] MILLER T C, ZWERDLING D. Brain injuries remain undiagnosed in thousands of soldiers [DB/OL]. (2010-06-07)[2021-02-03]. https://www.propublica.org/article/brain-injuries-remain-undiagnosed-in-thousands-of-soldiers. [10] KOBEISSY F H. Brain neurotrauma: molecular, neuropsychological, and rehabilitation aspects [M]. Boca Raton: CRC Press, 2015. [11] TEASDALE G, JENNETT B. Assessment and prognosis of coma after head injury [J]. Acta Neurochirurgica, 1976, 34(1): 45–55. DOI: 10.1007/BF01405862. [12] DAL CENGIO LEONARDI A, BIR C A, RITZEL D V, et al. Intracranial pressure increases during exposure to a shock wave [J]. Journal of Neurotrauma, 2011, 28(1): 85–94. DOI: 10.1089/neu.2010.1324. [13] DAL CENGIO LEONARDI A, KEANE N J, BIR C A, et al. Head orientation affects the intracranial pressure response resulting from shock wave loading in the rat [J]. Journal of Biomechanics, 2012, 45(15): 2595–2602. DOI: 10.1016/j.jbiomech.2012.08.024. [14] DAL CENGIO LEONARDI A, KEANE N J, HAY K, et al. Methodology and evaluation of intracranial pressure response in rats exposed to complex shock waves [J]. Annals of Biomedical Engineering, 2013, 41(12): 2488–2500. DOI: 10.1007/s10439-013-0850-2. [15] BAUMAN R A, LING G, TONG L, et al. An introductory characterization of a combat-casualty-care relevant swine model of closed head injury resulting from exposure to explosive blast [J]. Journal of Neurotrauma, 2009, 26(6): 841–860. DOI: 10.1089/neu.2008.0898. [16] BOLANDER R, MATHIE B, BIR C, et al. Skull flexure as a contributing factor in the mechanism of injury in the rat when exposed to a shock wave [J]. Annals of Biomedical Engineering, 2011, 39(10): 2550. DOI: 10.1007/s10439-011-0343-0. [17] MUGGIA-SULLAM M. Blast injury [M]//GULLO A. Anaesthesia, Pain, Intensive Care and Emergency Medicine. Milano: Springer, 2002: 363−368. DOI: 10.1007/978-88-470-2099-3_34. [18] CHOI C H. Mechanisms and treatment of blast induced hearing loss [J]. Korean Journal of Audiology, 2012, 16(3): 103–107. DOI: 10.7874/kja.2012.16.3.103. [19] SHUPAK A, DOWECK I, NACHTIGAL D, et al. Vestibular and audiometric consequences of blast injury to the ear [J]. Archives of Otolaryngology–Head & Neck Surgery, 1993, 119(12): 1362–1367. DOI: 10.1001/archotol.1993.01880240100013. [20] DE RÉGLOIX S B, CRAMBERT A, MAURIN O, et al. Blast injury of the ear by massive explosion: a review of 41 cases [J]. Journal of the Royal Army Medical Corps, 2017, 163(5): 333–338. DOI: 10.1136/jramc-2016-000733. [21] QURESHI T A, AWAN M S, HASSAN N H, et al. Effects of bomb blast injury on the ears: the Aga Khan University Hospital experience [J]. The Journal of the Pakistan Medical Association, 2017, 67(9): 1313–1317. [22] AKULA P, HUA Y, GU L X. Blast-induced mild traumatic brain injury through ear canal: a finite element study [J]. Biomedical Engineering Letters, 2015, 5(4): 281–288. DOI: 10.1007/s13534-015-0204-0. [23] SHUKER S T. Maxillofacial air-containing cavities, blast implosion injuries, and management [J]. Journal of Oral and Maxillofacial Surgery, 2010, 68(1): 93–100. DOI: 10.1016/j.joms.2009.07.077. [24] HAXEL B R, GRANT L, MACKAY-SIM A. Olfactory dysfunction after head injury [J]. Journal of Head Trauma Rehabilitation, 2008, 23(6): 407–413. DOI: 10.1097/01.htr.0000341437.59627.ec. [25] XYDAKIS M S, MULLIGAN L P, SMITH A B, et al. Olfactory impairment and traumatic brain injury in blast-injured combat troops: a cohort study [J]. Neurology, 2015, 84(15): 1559–1567. DOI: 10.1212/WNL.0000000000001475. [26] AKULA P K, HUA Y, GU L X. Role of frontal sinus on primary blast-induced traumatic brain injury [J]. Journal of Medical Devices, 2013, 7(3): 030925. DOI: 10.1115/1.4024492. [27] DEMAR J, SHARROW K, HILL M, et al. Effects of primary blast overpressure on retina and optic tract in rats [J]. Frontiers in Neurology, 2016, 7: 59. DOI: 10.3389/fneur.2016.00059. [28] KOLIATSOS V E, CERNAK I, XU L Y, et al. A mouse model of blast injury to brain: initial pathological, neuropathological, and behavioral characterization [J]. Journal of Neuropathology & Experimental Neurology, 2011, 70(5): 399–416. DOI: 10.1097/NEN.0b013e3182189f06. [29] WANG H C H, CHOI J H, GREENE W A, et al. Pathophysiology of blast-induced ocular trauma with apoptosis in the retina and optic nerve [J]. Military Medicine, 2014, 179(S8): 34–40. DOI: 10.7205/MILMED-D-13-00504. [30] CHOI J H, GREENE W A, JOHNSON A J, et al. Pathophysiology of blast-induced ocular trauma in rats after repeated exposure to low-level blast overpressure [J]. Clinical & Experimental Ophthalmology, 2015, 43(3): 239–246. DOI: 10.1111/ceo.12407. [31] FIEVISOHN E, BAILEY Z, GUETTLER A, et al. Primary blast brain injury mechanisms: current knowledge, limitations, and future directions [J]. Journal of Biomechanical Engineering, 2018, 140(2): 020806. DOI: 10.1115/1.4038710. [32] ZHU F, CHOU C C, YANG K H, et al. A theoretical analysis of stress wave propagation in the head under primary blast loading [J]. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine, 2014, 228(5): 439–445. DOI: 10.1177/0954411914530882. [33] NYEIN M K, JASON A M, YU L, et al. Reply to Moss et al: military and medically relevant models of blast-induced traumatic brain injury vs. ellipsoidal heads and helmets [J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(17): E83. DOI: 10.1073/pnas.1102626108. [34] ROMBA J J, MARTIN P. The propagation of air shock waves on a biophysical model: TM-17-61 [R]. Aberdeen: Human Engineering Lab Aberdeen Proving Ground, 1961. [35] MOSS W C, KING M J, BLACKMAN E G. Skull flexure from blast waves: a mechanism for brain injury with implications for helmet design [J]. Physical Review Letters, 2009, 103(10): 108702. DOI: 10.1103/PhysRevLett.103.108702. [36] BOLANDER H G, PERSSON L, HILLERED L, et al. Regional cerebral blood flow and histopathologic changes after middle cerebral artery occlusion in rats [J]. Stroke, 1989, 20(7): 930–937. DOI: 10.1161/01.STR.20.7.930. [37] LI Z J, DU Z B, YOU X C, et al. Numerical study on dynamic mechanism of brain volume and shear deformation under blast loading [J]. Acta Mechanica Sinica, 2019, 35(5): 1104–1119. DOI: 10.1007/s10409-019-00875-w. [38] OEHMICHEN M, MEISSNER C, KÖNIG H G. Brain injury after gunshot wounding: morphometric analysis of cell destruction caused by temporary cavitation [J]. Journal of Neurotrauma, 2000, 17(2): 155–162. DOI: 10.1089/neu.2000.17.155. [39] XI X F, ZHONG P. Dynamic photoelastic study of the transient stress field in solids during shock wave lithotripsy [J]. The Journal of the Acoustical Society of America, 2001, 109(3): 1226–1239. DOI: 10.1121/1.1349183. [40] HONG Y, SARNTINORANONT M, SUBHASH G, et al. Localized tissue surrogate deformation due to controlled single bubble cavitation [J]. Experimental Mechanics, 2016, 56(1): 97–109. DOI: 10.1007/s11340-015-0024-2. [41] PANZER M B, MYERS B S, CAPEHART B P, et al. Development of a finite element model for blast brain injury and the effects of CSF cavitation [J]. Annals of Biomedical Engineering, 2012, 40(7): 1530–1544. DOI: 10.1007/s10439-012-0519-2. [42] CRAMER Ⅲ H C, ESTRADA J B, SCIMONE M T, et al. Inertial microcavitation as a neural cell damage mechanism in a 3D in vitro model of blast traumatic brain injury [J]. Biophysical Journal, 2018, 114(3): 518A. DOI: 10.1016/j.bpj.2017.11.2828. [43] GOELLER J, WARDLAW A, TREICHLER D, et al. Investigation of cavitation as a possible damage mechanism in blast-induced traumatic brain injury [J]. Journal of Neurotrauma, 2012, 29(10): 1970–1981. DOI: 10.1089/neu.2011.2224. [44] SALZAR R S, TREICHLER D, WARDLAW A, et al. Experimental investigation of cavitation as a possible damage mechanism in blast-induced traumatic brain injury in post-mortem human subject heads [J]. Journal of Neurotrauma, 2017, 34(8): 1589–1602. DOI: 10.1089/neu.2016.4600. [45] BHATTACHARJEE Y. Shell shock revisited: solving the puzzle of blast trauma [J]. Science, 2008, 319(5862): 406–408. DOI: 10.1126/science.319.5862.406. [46] CHEN Y, HUANG W. Non-impact, blast-induced mild TBI and PTSD: concepts and caveats [J]. Brain Injury, 2011, 25(7/8): 641–650. DOI: 10.3109/02699052.2011.580313. [47] GANPULE S, ALAI A, PLOUGONVEN E, et al. Mechanics of blast loading on the head models in the study of traumatic brain injury using experimental and computational approaches [J]. Biomechanics and Modeling in Mechanobiology, 2013, 12(3): 511–531. DOI: 10.1007/s10237-012-0421-8. [48] BAIN A C, MEANEY D F. Tissue-level thresholds for axonal damage in an experimental model of central nervous system white matter injury [J]. Journal of Biomechanical Engineering, 2000, 122(6): 615–622. DOI: 10.1115/1.1324667. [49] WRIGHT R M, POST A, HOSHIZAKI B, et al. A multiscale computational approach to estimating axonal damage under inertial loading of the head [J]. Journal of Neurotrauma, 2013, 30(2): 102–118. DOI: 10.1089/neu.2012.2418. [50] GIORDANO C, KLEIVEN S. Connecting fractional anisotropy from medical images with mechanical anisotropy of a hyperviscoelastic fibre-reinforced constitutive model for brain tissue [J]. Journal of the Royal Society Interface, 2014, 11(91): 20130914. DOI: 10.1098/rsif.2013.0914. [51] GUPTA R K, TAN X G, SOMAYAJI M R, et al. Multiscale modelling of blast-induced TBI mechanobiology—from body to neuron to molecule [J]. Defence Life Science Journal, 2017, 2(1): 3–13. DOI: 10.14429/dlsj.2.10369. [52] WARD C, CHAN M, NAHUM A. Intracranial pressure—a brain injury criterion [J]. SAE Transactions, 1980: 3867–3880. https://www.jstor.org/stable/44632636. [53] RODRÍGUEZ-MILLÁN M, TAN L B, TSE K N, et al. Effect of full helmet systems on human head responses under blast loading [J]. Materials & Design, 2017, 117: 58–71. DOI: 10.1016/j.matdes.2016.12.081. [54] GARCIA-GONZALEZ D, RACE N S, VOETS N L, et al. Cognition based bTBI mechanistic criteria; a tool for preventive and therapeutic innovations [J]. Scientific Reports, 2018, 8(1): 10273. DOI: 10.1038/s41598-018-28271-7. [55] KALRA A, ZHU F, FENG K, et al. Development and validation of a numerical model of the swine head subjected to open-field blasts [J]. Shock Waves, 2017, 27(6): 947–964. DOI: 10.1007/s00193-017-0760-6. [56] ZHU F, CHOU C C, YANG K H, et al. Some considerations on the threshold and inter-species scaling law for primary blast-induced traumatic brain injury: a semi-analytical approach [J]. Journal of Mechanics in Medicine and Biology, 2013, 13(4): 1350065. DOI: 10.1142/S0219519413500656. [57] ZHU F, SKELTON P, CHOU C C, et al. Biomechanical responses of a pig head under blast loading: a computational simulation [J]. International Journal for Numerical Methods in Biomedical Engineering, 2013, 29(3): 392–407. DOI: 10.1002/cnm.2518. [58] ZHU F, WAGNER C, DAL CENGIO LEONARDI A, et al. Using a gel/plastic surrogate to study the biomechanical response of the head under air shock loading: a combined experimental and numerical investigation [J]. Biomechanics and Modeling in Mechanobiology, 2012, 11(3): 341–353. DOI: 10.1007/s10237-011-0314-2. [59] ZHU F, MAO H, LEONARDI A D C, et al. Development of an FE model of the rat head subjected to air shock loading [J]. Stapp Car Crash Journal, 2010, 54: 211. DOI: 10.4271/2010-22-0011. [60] BASS C R, PANZER M B, RAFAELS K A, et al. Brain injuries from blast [J]. Annals of Biomedical Engineering, 2012, 40(1): 185–202. DOI: 10.1007/s10439-011-0424-0. [61] COURTNEY M W, COURTNEY A C. Working toward exposure thresholds for blast-induced traumatic brain injury: thoracic and acceleration mechanisms [J]. Neuroimage, 2011, 54(S1): S55-S61. DOI: 10.1016/j.neuroimage.2010.05.025. [62] 栗志杰, 由小川, 柳占立, 等. 一种物理头部模型和测试系统: CN201810055338.5 [P]. 2018-06-15.LI Z J, YOU X C, LIU Z L, et al. Physical head model and test system: CN201810055338.5 [P]. 2018-06-15. [63] NEMAT-NASSER S, AMIRKHIZI A, HOLZWORTH K, et al. Modification and engineering of HSREP to achieve unique properties: block copolymer-based multiscale composites for shock mitigation [J]. Elastomeric Polymers with High Rate Sensitivity: Applications in Blast, Shockwave, and Penetration Mechanics, 2015: 319–335. DOI: 10.1016/B978-0-323-35400-4.00009-X. [64] LI J T, MA T, HUANG C, et al. Protective mechanism of helmet under far-field shock wave [J]. International Journal of Impact Engineering, 2020, 143: 103617. DOI: 10.1016/j.ijimpeng.2020.103617. [65] LIU M D, ZHANG C, LIU W B, et al. A novel rat model of blast-induced traumatic brain injury simulating different damage degree: implications for morphological, neurological, and biomarker changes [J]. Frontiers in Cellular Neuroscience, 2015, 9: 168. DOI: 10.3389/fncel.2015.00168. [66] RUBOVITCH V, TEN-BOSCH M, ZOHAR O, et al. A mouse model of blast-induced mild traumatic brain injury [J]. Experimental Neurology, 2011, 232(2): 280–289. DOI: 10.1016/j.expneurol.2011.09.018. [67] DAVIDSSON J, ANGERIA M, RISLING M. Injury threshold for sagittal plane rotational induced diffuse axonal injuries[C] // Proceedings of the International Research Conference on the Biomechanics of Impact (IRCOBI). York, UK: SAE, 2009: 43–56. [68] RISLING M, SKÖLD M, LARSSON I L, et al. Leakage of S-100 protein after high velocity penetration injury to the brain [C]// Proceedings of the 7th International Neurotrauma Symposium. Adelaide: Medimond, 2004: 119–124. [69] CHENG J M, GU J W, MA Y, et al. Development of a rat model for studying blast-induced traumatic brain injury [J]. Journal of the Neurological Sciences, 2010, 294(1/2): 23–28. DOI: 10.1016/j.jns.2010.04.010. [70] AGOSTON D V, ELSAYED M. Serum-based protein biomarkers in blast-induced traumatic brain injury spectrum disorder [J]. Frontiers in Neurology, 2012, 3: 107. DOI: 10.3389/fneur.2012.00107. [71] D’HOOGE R, DE DEYN P P. Applications of the Morris water maze in the study of learning and memory [J]. Brain Research Reviews, 2001, 36(1): 60–90. DOI: 10.1016/S0165-0173(01)00067-4. [72] MORRIS R G M, GARRUD P, RAWLINS J N P, et al. Place navigation impaired in rats with hippocampal lesions [J]. Nature, 1982, 297(5868): 681–683. DOI: 10.1038/297681a0. [73] FRANKLYN M, LEE P V S. Military injury biomechanics: the cause and prevention of impact injuries [M]. Boca Raton: CRC Press, 2017. [74] OJO J O, MOUZON B, ALGAMAL M, et al. Chronic repetitive mild traumatic brain injury results in reduced cerebral blood flow, axonal injury, gliosis, and increased T-tau and tau oligomers [J]. Journal of Neuropathology & Experimental Neurology, 2016, 75(7): 636–655. DOI: 10.1093/jnen/nlw035. [75] LEE J, JING B B, PORATH L E, et al. Shock wave energy dissipation in catalyst-free poly (dimethylsiloxane) vitrimers [J]. Macromolecules, 2020, 53(12): 4741–4747. DOI: 10.1021/acs.macromol.0c00784. [76] SARVA S S, DESCHANEL S, BOYCE M C, et al. Stress-strain behavior of a polyurea and a polyurethane from low to high strain rates [J]. Polymer, 2007, 48(8): 2208–2213. DOI: 10.1016/j.polymer.2007.02.058. [77] PONTALIER Q, LHOUMEAU M, FROST D L. Blast wave mitigation in granular materials [J]. AIP Conference Proceedings, 2018, 1979(1): 110014. DOI: 10.1063/1.5044933. [78] GRUJICIC M, RAMASWAMI S, SNIPES J S, et al. RETRACTED: potential improvement in helmet blast-protection via the use of a polyurea external coating: combined experimental/computational analyses [J]. Proceedings of the Institution of Mechanical Engineers, Part L: Journal of Materials: Design and Applications, 2020, 234(3): 337–367. DOI: 10.1177/1464420716644472. [79] JENSON D, UNNIKRISHNAN V. Multiscale simulation of ballistic composites for blast induced traumatic brain injury mitigation [C] // Proceedings of the ASME 2014 International Mechanical Engineering Congress and Exposition. Montreal: American Society of Mechanical Engineers, 2014. DOI: 10.1115/IMECE2014-40262. [80] SINGH D, CRONIN D S. Efficacy of visor and helmet for blast protection assessed using a computational head model [J]. Shock Waves, 2017, 27(6): 905–918. DOI: 10.1007/s00193-017-0732-x. [81] ZHANG T G, SATAPATHY S S. Effect of helmet pads on the load transfer to head under blast loadings [C] // Proceedings of the ASME 2014 International Mechanical Engineering Congress and Exposition. Montreal: American Society of Mechanical Engineers, 2014. DOI: 10.1115/IMECE2014-37143. [82] VALVERDE-MARCOS B, RUBIO I, ANTONA-MAKOSHI J, et al. Numerical analysis of EOD helmet under blast load events using human head model [J]. Applied Sciences, 2020, 10(22): 8227. DOI: 10.3390/app10228227. [83] TSE K M, TAN L B, SAPINGI M A B, et al. The role of a composite polycarbonate-aerogel face shield in protecting the human brain from blast-induced injury: a fluid-structure interaction (FSI) study [J]. Journal of Sandwich Structures & Materials, 2019, 21(7): 2484–2511. DOI: 10.1177/1099636217733369. -






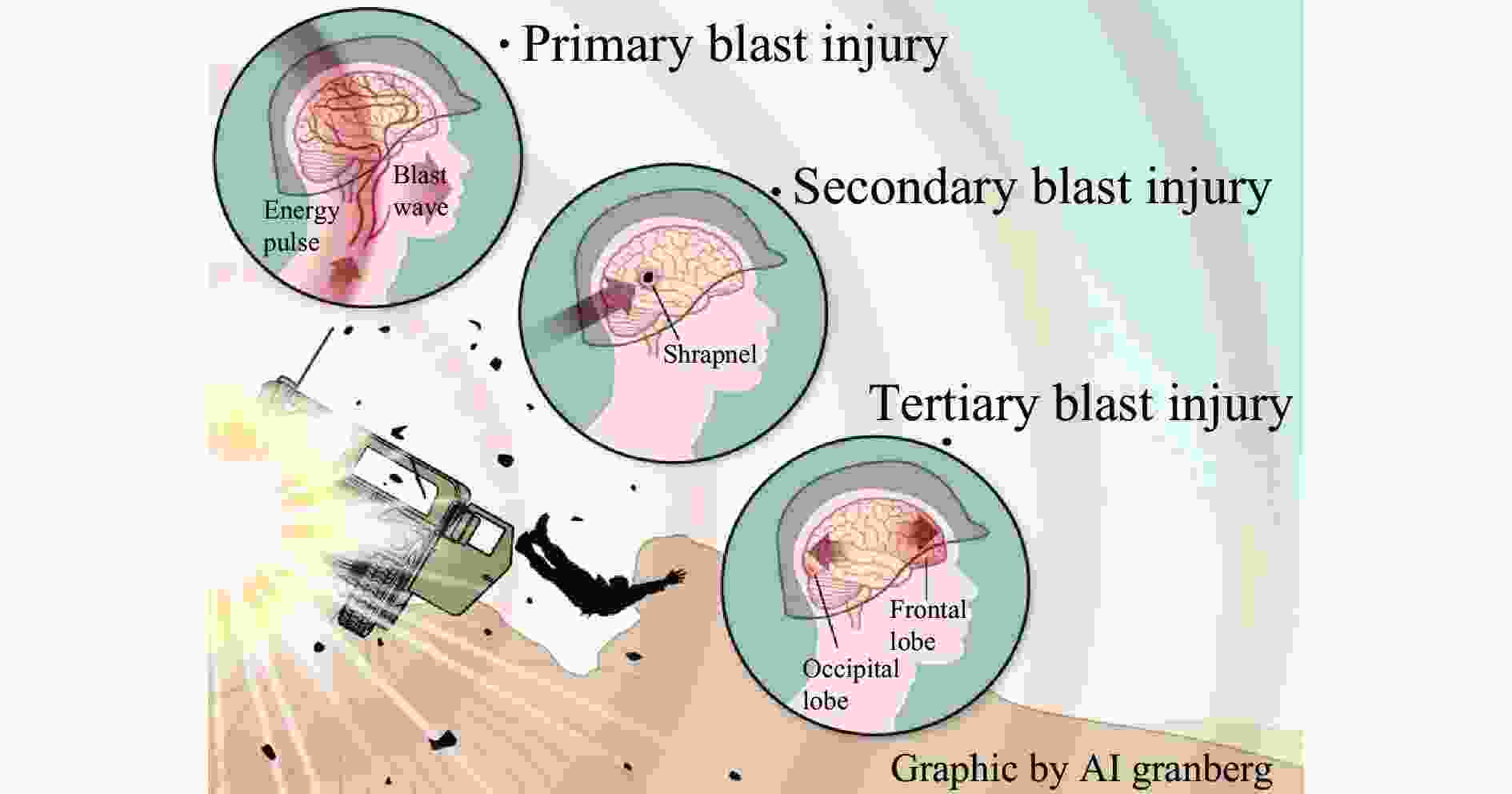
 下载:
下载: